
Quelle: Wikimedia Commons, File:Ernest Rutherford LOC.jpg, George Grantham Bain Collection (Library of Congress), PD-US "No known restrictions on publication."
Zusammenfassung des Buchkapitels:
Sind Atome elementar, oder besitzen sie eine Substruktur? Ernest Rutherford konnte diese Frage mit seinem berühmten Streuexperiment zwischen 1911 und 1913 klären.

Quelle:
Wikimedia Commons, File:Ernest Rutherford LOC.jpg, George Grantham Bain Collection (Library of Congress),
PD-US "No known restrictions on publication."
Dabei schoss er sogenannte Alphateilchen (Heliumkerne) auf eine sehr dünne Goldfolie.
Es zeigte sich dabei, dass die Mehrheit der Alphateilchen
die Metallfolie fast ungestört durchdringt! Nur wenige
Alphateilchen werden aus ihrer Bahn abgelenkt, das aber teilweise deutlich.
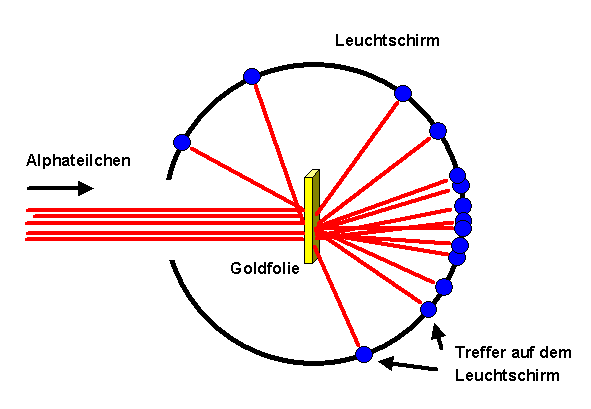
Aus diesem und vielen weiteren Experimenten wissen wir:
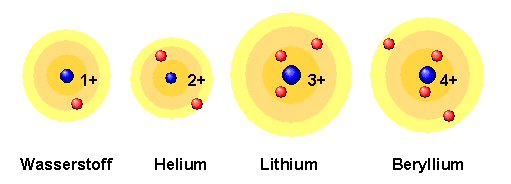
Atome bestehen im Wesentlichen aus leerem Raum. Sie haben eine Größe zwischen einem halben und etwa drei Angström ( 1 Angström = 1 A = 10− 7 mm = 10− 10 m). Zum Vergleich: sichtbares Licht besitzt Wellenlängen zwischen 4000 und 8000 Angström. In jedem Atom befindet sich ein sehr kleines, positiv geladenes, recht massives Objekt: der Atomkern. Atomkerne besitzen nur etwa ein Zehntausendstel der Größe eines Atoms, tragen aber dennoch fast dessen gesamte Masse. Typische Atomkerne sind nur einige Fermi groß ( 1 Fermi = 1 fm = 10− 5 A = 10− 15 m).
Da Atome normalerweise nicht elektrisch geladen sind, muss die elektrische Ladung der Atomkerne durch weitere entgegengesetzt geladene Objekte kompensiert werden. Diese Objekte kann man beispielsweise durch den Photoeffekt aufspüren, bei dem man geeignetes Licht im Vakuum auf eine Alkalimetalloberfläche fallen lässt. Es werden dabei winzig kleine negativ geladene Teilchen aus den Atomen des Metalls herausgeschlagen: die Elektronen.
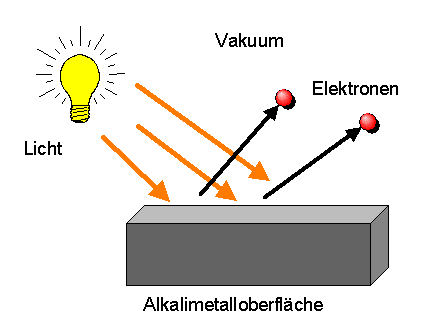
Elektronen sind mehrere tausend mal leichter als Atome.
Sie bewegen sich um den Atomkern
und schirmen dessen Ladung nach außen
hin ab. Die elektrische Anziehungskraft zwischen
Elektronen und Atomkern hält das Atom dabei zusammen.
Elektronen sind im Standardmodell elementare Teilchen – sie haben
keine messbare Substruktur oder Ausdehnung.
a) Internetgrafiken
b) Rutherford-Streuformel
Eine schöne Darstellung des Heliumatoms habe ich in Wikipedia: Atom gefunden:
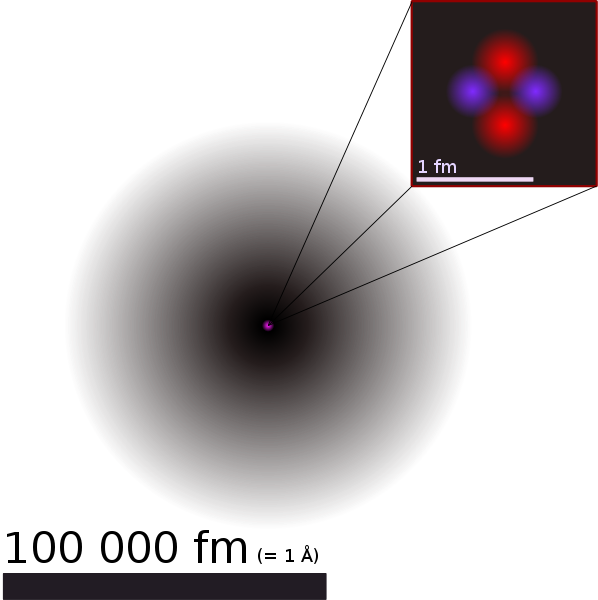
Heliumatom
Quelle:
Wikimedia Commons File:Helium atom QM DE.s,
CC BY-SA 3.0 DEED
Der graue Bereich stellt die Elektronenhülle des Heliumatoms dar. Je dunkler der Grauton ist, umso größer
ist die Wahrscheinlichkeit, dort eines der beiden Elektronen zu finden.
Der Atomkern im Zentrum ist winzig: Wenn in der Darstellung das Atom etwa 10 cm groß ist so ist der Atomkern
nur ein Tausendstel Millimeter groß – also weniger als ein Staubkorn.
In Wikipedia findet man auch die folgende schöne Darstellung des Rutherfordschen Streuversuchs:
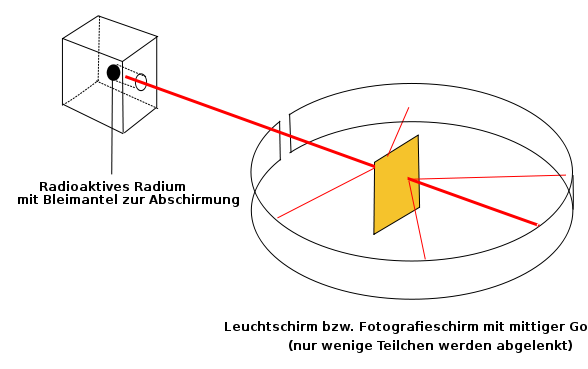
Rutherfords Streuversuch, bei dem eine Goldfolie mit Alphateilchen beschossen wird.
Quelle:
Wikimedia Commons File:Rutherfordscher Streuversuch.svg,
Urheber: Sundance Raphael, gemeinfrei.
Im Rutherford-Streuversuch ist die Wahrscheinlichkeit dafür, dass ein Alphateilchen in einen Winkelbereich zwischen \( \theta \) und \( \theta + d\theta \) (mit kleinem \( d\theta \) ) abgelenkt wird, gegeben durch \[ P(\theta) \, d\theta = A \, \frac{ \cos{ (\theta/2) } }{ [\sin{ (\theta/2) }]^3 } \, d\theta \] mit einer Konstante \(A\), die von den Teilchenladungen und der Teilchenenergie abhängt. Hier ist die grafische Darstellung dieser Formel:
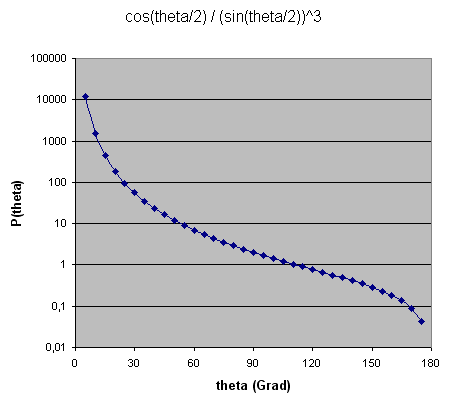
Winkel-Ablenkwahrscheinlichkeit für die Alphateilchen in Rutherfords Streuversuch
Die meisten Alphateilchen werden also nur sehr wenig abgelenkt, denn die Wahrscheinlichkeit
fällt zu größeren Ablenkwinkeln \(\theta\) hin steil ab
(die x-Achse in der Grafik ist logarithmisch skaliert!).
Dennoch gibt es auch für große Ablenkwinkel \(\theta\) immer noch einige
wenige dahin abgelenkte Alphateilchen.
Das sind genau diejenigen Alphateilchen, die im klassischen Bild dem
Atomkern zufällig sehr nahe gekommen sind.
Literatur:
© Jörg Resag, www.joerg-resag.de
last modified on 16 December 2023