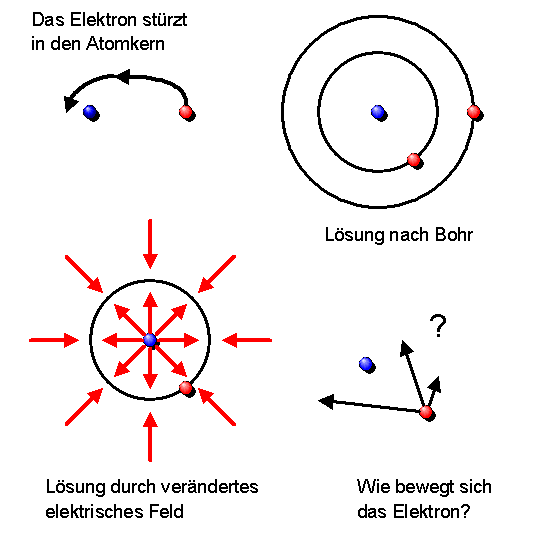
Zusammenfassung des Buchkapitels:
Wie können wir uns im Atom die Bewegung der Elektronen um den Atomkern herum genauer vorstellen? Sie könnten sich auf Kreis- oder Ellipsenbahnen bewegen, ähnlich wie Planeten um die Sonne. Nach den Maxwellgleichungen müssten sie dabei aber wie ein Radiosender Energie abstrahlen und in etwa \(10^{-11}\) Sekunden (entsprechend einem Lichtweg von etwa 3 mm) auf den Atomkern herabstürzen (siehe Zusatzinformationen unten). Hier einige Möglichkeiten, wie man das Problem lösen könnte:


Quelle:
Wikimedia Commons File:Niels Bohr Albert Einstein2 by Ehrenfest.jpg, dort public domain
a) Berechnung der theoretischen Lebensdauer eines Atoms
Wie schnell stürzt ein kreisendes Elektron nach den klassischen Maxwellgleichungen in den Atomkern? Man kann diese Zeit mit der Larmorschen Formel wie folgt grob abschätzen:
Nach der nichtrelativistischen Larmorschen Formel (siehe Wikipedia: Larmor formula) strahlt eine Ladung \(e\) bei einer Beschleunigung \(a\) die Leistung \[ P = \frac{2}{3} \, k \, \frac{e^{2} \, a^{2}}{c^{3}} \] ab (in SI-Einheiten) mit \[ k = \frac{1}{4 \pi \epsilon_{0}} \] (siehe Kapitel 2.4) Dabei ist \(c\) die Lichtgeschwindigkeit.
Ein Elektron im Abstand \(r\) vom Atomkern erfährt die Beschleunigung \[ a = \frac{F}{M} = k \, \frac{e^{2}}{r^{2}} \, \frac{1}{M} \] mit der Elektronenmasse \(M\) (hier groß geschrieben, um nicht mit m für Meter verwechselt zu werden).
Wir setzen dieses \(a\) oben ein und fügen an passenden Stellen die Lichtgeschwindigkeit \(c\) und das Plancksche Wirkungsquantum \(\hbar\) ein, um auf wohlbekannte Größen zurückgreifen zu können (ist praktisch, geht aber auch anders): \[ P = \frac{2}{3} \, k \, \frac{e^{2} \, a^{2}}{c^{3}} = \] \[ = \frac{2}{3} \, k \, \frac{e^{2}}{c^{3}} \, k^2 \, \frac{e^{4}}{r^{4}} \, \frac{1}{M^2} = \] \[ = \frac{2}{3} \, (k \, e^2)^3 \, \frac{c}{r^{4} M^{2} c^{4}} = \] \[ = \frac{2}{3} \, \left( \frac{k \, e^{2}}{\hbar c} \right)^{3} \, (\hbar c)^3 \, \frac{c}{r^{4} M^{2} c^{4}} \] Der Term \( \frac{k \, e^{2}}{\hbar c} \) ist die sogenannte Kopplungskonstante (Feinstrukturkonstante) der elektromagnetischen Wechselwirkung (siehe Kapitel 6.2). Sie hat ungefähr den Wert \[ \frac{k \, e^{2}}{\hbar c} = \frac{1}{137} \] Das Produkt \( \hbar c \) hat ungefähr den Wert \[ \hbar c = 200 \, \mathrm{MeV} \cdot \mathrm{fm} \] (siehe Kapitel 3.4). Für die Elektronenmasse \( M c^{2} \) setzen wir den Näherungswert \[ M c^{2} = 0,5 \, \mathrm{MeV} \] ein, und für die Lichtgeschwindigkeit \(c\) den Wert \[ c = 3 \cdot 10^{8} \, \frac{\mathrm{m}}{\mathrm{s}} \] Der Abstand \(r\) des Elektrons zum Atomkern ist im Wasserstoffatom klassisch etwa \[ r = 0,5 \, \mathrm{A} \] (das nennt man auch den Bohr-Radius). Das ergibt zusammen: \[ P = \frac{2}{3} \, \left( \frac{k \, e^{2}}{\hbar c} \right)^{3} \, (\hbar c)^3 \, \frac{c}{r^{4} M^{2} c^{4}} \] \[ = \frac{2}{3} \cdot \left( \frac{1}{137} \right)^{3} \cdot (200 \, \mathrm{MeV} \cdot \mathrm{fm})^3 \cdot \] \[ \cdot \, 3 \cdot 10^{8} \, \frac{\mathrm{m}}{\mathrm{s}} \cdot \frac{1}{(0,5 \, \mathrm{A})^4 \cdot (0,5 \, \mathrm{MeV})^2} \] Alle Längen rechnen wir in Meter um: \[ 1 \, \mathrm{fm} = 10^{- 15} \, \mathrm{m} \] \[ 1 \, \mathrm{A} = 10^{- 10} \, \mathrm{m} \] Die Einheit Meter kürzt sich insgesamt heraus. Damit haben wir: \[ P = \frac{2}{3} \cdot \left( \frac{1}{137} \right)^{3} \cdot 200^3 \cdot 10^{- 45} \cdot \] \[ \cdot \, 3 \cdot 10^{8} \cdot 2^{6} \cdot 10^{40} \, \frac{\mathrm{MeV}}{\mathrm{s}} \] \[ = 4 \cdot 10^{5} \, \frac{\mathrm{MeV}}{\mathrm{s}} = 4 \cdot 10^{11} \, \frac{\mathrm{eV}}{\mathrm{s}} \] (ich hoffe ich habe mich nicht verrechnet). Das ist die Leistung, die das Elektron aufgrund der Anziehungskraft des Atomkerns in diesem Abstand auf seiner Kreisbahn abstrahlen würde, wobei es sich an den Atomkern weiter annähert.
Nun besitzt das Wasserstoffatom eine Bindungsenergie von 13,6 eV, d.h. soviel Energie wurde bei Bildung des Wasserstoffatoms frei. Klassisch entspricht dies der Energie, die das Elektron abgibt, wenn es sich bis auf etwa 0,5 Angström an den Atomkern annähert. Die Bindungsenergie wächst umgekehrt proportional zum Abstand, d.h. sie verdoppelt sich, wenn man den Abstand halbiert. Wenn das Elektron nun weitere 13,6 eV abstrahlt, so halbiert sich sein Abstand zum Atomkern. Bei der obigen Strahlungsleistung würde das etwa \[ t = \frac{13,6}{4 \cdot 10^{11}} \, \mathrm{s} = 3 \cdot 10^{- 11} \, \mathrm{s} \] dauern. Das ist natürlich nur eine grobe Abschätzung, da die Strahlungsleistung ja bei der Annäherung anwächst, was die Zeit verkürzt (den Vorfaktor 3 sollten wir also nicht allzu ernst nehmen).
Im neuen Abstand von nur noch 0,25 Angström ist die Kraft und damit die Beschleunigung vier Mal so groß wie bei 0,5 Angström. Die Abstrahlungsleistung wächst daher um den Faktor 16 an. Um den Abstand erneut zu halbieren, muss die aktuelle Bindungsenergie von 27,2 eV nochmal abgestrahlt werden, so dass sich die Bindungsenergie insgesamt verdoppelt. Die abzustrahlende Energie verdoppelt sich also bei Halbierung des Abstandes, aber die Abstrahlungsleistung hat sich um den Faktor 16 vergrößert. Die Zeit für diese Abstrahlung verringert sich also um den Faktor 8. Wiederholen wir das immer wieder, so müssen wir die obige Zeit \(t\) mit dem Faktor \[ \left( 1 + \frac{1}{8} + \frac{1}{8^2} + \, ... \right) = \frac{1}{1 - 1/8} = \frac{8}{7} = 1,14 \] multiplizieren (wir haben hier die bekannte Formel für die geometrische Reihe verwendet), was den Wert kaum verändert. Insgesamt erhalten wir also, dass die Gesamtzeit \(t\) für den Absturz zum Atomkern ungefähr die Größenordnung \[ 10^{- 11} \, \mathrm{s} \] besitzt. Das Wasserstoffatom müsste also innerhalb von einer Hundert-Milliardstel Sekunde in sich zusammenstürzen.
Literatur:
© Jörg Resag, www.joerg-resag.de
last modified on 20 December 2023